Alkaline Phosphatase
1- این تست به چه نامهای دیگری شناخته میشود؟
آلکالن فسفاتاز، ALP, Alk, Alkaline phosphatase isoenzymes
2- هدف از انجام تست چیست؟
هدف از انجام این آزمایش، غربالگری یا پایش درمان اختلالات کبدی یا استخوانی است.
آلکالاین فسفاتاز (ALP) آنزیمی است که در چندین بافت در سراسر بدن (کبد، استخوان، روده، جفت و نئوپلاستیک (توموری)) یافت می شود. بیشترین غلظت ALP در سلولهای استخوان و کبد وجود دارد. افزایش میزان ALP در خون معمولا در اثر بیماری کبد یا اختلالات استخوانی ایجاد می شود. این آزمایش میزان ALP در خون را اندازه گیری می کند. هر یک از بافت هایی که ALP دارند، اشکال متفاوتی از ALP را تولید می کنند که ایزوآنزیم های ALP نامیده می شوند
3- این تست چه زمانی درخواست میشود؟
آزمایش ALP ممکن است به عنوان چکاپ معمولی آزمایشگاهی
که اغلب با آزمایشات دیگری (AST, ALT, Alb, Total protein, bilirubin, GGT, PT) به نام پانل کبدی همراه است، انجام شود. همچنین زمانی که علائم اختلال در کبد یا استخوان وجود دارد، انجام می شود.
علائم و نشانه های اختلال کبدی ممکن است شامل موارد زیر باشد:
- ضعف ، خستگی
- کاهش اشتها
- حالت تهوع، استفراغ
- تورم شکم و یا درد شکم
- زردی (یرقان)
- ادرار تیره و مدفوع روشن
- خارش
علائم و نشانه های اختلال استخوانی ممکن است شامل موارد زیر باشد:
- درد استخوان، با یا بدون درد مفاصل
- شکستگی مکرر استخوان ها
- تغییر شکل پیدا کردن استخوان ها
4- تستهای آزمایشگاهی مکمل این آزمایش کدامند؟
AST, ALT, GGT, Bilirubin, Alb, Total protein
5- چه نوع نمونهای برای این تست درخواست میشود؟
نمونه خون
6- مراجعه کننده قبل از انجام آزمایش باید چه شرایطی را رعایت کند؟
قبل از انجام این تست نیاز به رعایت شرایط ناشتایی بین 12 تا 14 ساعت می باشد. خوردن غذا ممکن است میزان این آنزیم را در خون تغییر دهد.
7- نحوه جمعآوری نمونه چگونه است؟
برای این آزمایش، خونگیری از ورید بازویی انجام می شود. قبل از نمونه گیری، فرد مراجعه کننده باید داروهایی که مصرف می کند به همراه آخرین زمان مصرف دارو را به اطلاع پرسنل نمونه گیر در آزمایشگاه برساند.
8- بهترین روش های انجام تست کدام اند؟
برای انجام این آزمایش از روش نیتروفنیل فسفات کینتیک استفاده می شود.
9- چه عواملی باعث تداخل و ایجاد نتایج کاذب در انجام تست میشود؟
- غذا خوردن میزان این آنزیم را در خون افزایش می دهد.
- داروهایی که می توانند میزان ALP را افزایش دهند عبارتند از: آلوپورینول، آنتی بیوتیک ها، آزاتیوپرین، کلشی سین، ایندومتاسین، متیل دوپا، متوترکسات.
- داروهایی که می توانند میزان ALP را کاهش دهند عبارتند از: اگزالات و نیتروفورانتوئین.
10- نتایج این تست چگونه گزارش میشود؟
میزان طبیعی ALP در خون برحسب IU/L بوده و در هر آزمایشگاه متفاوت است. این میزان در آزمایشگاه وحید بصورت ذیل است:
1 Days – 15 Years: 180 – 1200
> 15 Years(Men): 80 – 306
> 15 Years(Women): 64 – 306
افزایش ALP در مواد زیر مشاهده میشود:
- سیروز
- یرقان صفراوی (سنگ صفرا)
- کلستاز (داخل یا خارج کبدی)
- سرطان کبد یا سرطان متاستاز دهنده به کبد
- انسداد کبدی یا انسداد مجاری صفراوی
- هپاتیت
- مونونوکلئوز عفونی
- دیابت شیرین
- بیماری پاژه
- سرطان استخوان
- نرمی استخوان (راشیتیسم در کودکان یا استئومالاسی در بالغین)
- ایسکمی یا انفارکتوس روده
- پرکاری تیروئید
- پرکاری پاراتیروئید
کاهش ALP در موارد زیر مشاهده میشود:
- سوء تغذیه
- آنمی کشنده
- کم کاری تیروئید
- کمبود فسفات خون
11- مطالب مرتبط:
ایزوآنزیم های ALP یا ALP Isoenzymes:
همانطور که اشاره شد، آلکالاین فسفاتاز (ALP) آنزیمی است که در حداقل پنج بافت در سراسر بدن (کبد، استخوان، روده، جفت و نئوپلاستیک (توموری)) یافت می شود. بیشتر از 95 درصد فعالیت آنزیم ALP مربوط به کبد و استخوان است. هرگاه Total ALP افزایش پیدا کند، برای پی بردن به بافت تولید کننده آن نیاز به بررسی ایزوآنزیم های ALP می باشد. بنابراین آزمایش ALP isoenzymes زمانی انجام می شود که میزان ALP افزایش پیدا کرده باشد (بدون علایم بالینی مشخص) ولی منشأ و بافت تولید کننده آن مشخص نباشد. ایزوآنزیم های جفتی (Placental) و توموری بیشترین مقاومت به حرارت را دارند که از این خاصیت می توان در اندازه گیری ایزوآنزیم های ALP استفاده کرد. از متدهای اندازه گیری ایزوآنزیم های ALP می توان به “غیرفعالسازی با حرارت” اشاره کرد که بر اساس یکی از مهمترین ویژگی های آنزیم ALP یعنی میزان غیرفعال شدن متفاوت هر یک از ایزوآنزیم های ALP در حرارت های مختلف است. روش انجام بدین صورت است ابتدا سرم هر بیمار را به دو قسمت تقسیم می کنیم سپس یک قسمت از نمونه در بن ماری 65 درجه سانتیگراد به مدت 5 دقیقه قرار داده شده و پس از آن فورا در یک جعبه یخ قرار داده شود. این مرحله 100 درصد ایزوآنزیم های استخوان، کبد و روده غیر فعال می شود. اما ایزوآنزیم هایی که به حرارت مقاومت بیشتری دارند، (مانند ایزوآنزیم های جفتی و نئوپلاستیک) اگر در سرم بیمار وجود داشته باشد در چنین شرایطی باز هم فعال می مانند. باقیمانده هر نمونه در بن ماری 55 درجه سانتیگراد به مدت 16 دقیقه قرار داده شده سپس فورا در یک جعبه یخ قرار داده شود. میزان غیرفعال شدن برای ایزوآنزیم های استخوانی، کبدی و روده ای به ترتیب 95%، 60% و 55% است. یک اختلاف مهم ایزوآنزیم های ALP تفاوت در ویژگی های فیزیکوشیمیایی و الکتروفورتیک آنها است که از این خاصیت در متد “الکتروفورزیس” استفاده می شود. الکتروفورز ایزوآنزیم های ALP تکنیک قدرتمندی است که جهت پی بردن به علت و منشا افزایش ALP و تشخیص افتراقی بیماریهای مختلف از جمله متاستاز استخوان و کبد، تومورهای تخمدان، بیماری های کبد، روده، پاراتیروئید، استخوان و غیره بکار می رود. انواع مختلفی از الکتروفورز برای اندازه گیری ایزوآنزیم های ALP استفاده می شود. دستگاه HYDRASYS کمپانی Sebia با استفاده از ژل های HYDRAGEL ISO-PAL ، ایزوآنزیم های ALP سرم را به خوبی از هم جدا نموده و هم بصورت کیفی و هم کمی نسبی آنالیز می کند. روش HYDRAGEL ISO-PAL بر اساس افینیتی لکتین در الکتروفورز ژل آگارز است. شکل های زیر منحنی الکتروفورز ALP isoenzymes را نشان می دهند:
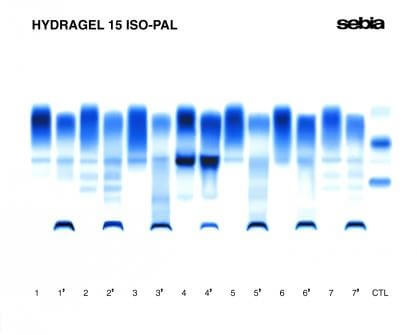
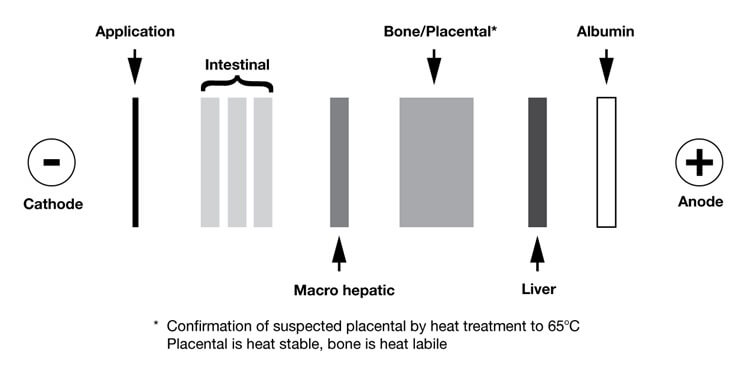
ایزوآنزیم کبدی
بخش عمده ی ایزوآنزیم کبدی ALP در جایگاه alpha 2 پروتئین سرم قرار می گیرد. ایزوآنزیم کبدی ALP در سرم همه افراد سالم یافت می شود و افزایش آن در بسیاری از شرایط دیده می شود از جمله: اختلال کبدی ناشی از مصرف دارو، کلستاز نئوپلاستیک کبد یا صفرا، کلستاز ناشی از هپاتیت ویروسی و سیروز.
ایزوآنزیم استخوانی
ایزوآنزیم استخوانی ALP در جایگاه beta 1 پروتئین سرم قرار می گیرد. مقادیر ناچیزی از این ایزوآنزیم در سرم همه افراد سالم وجود دارد. افزایش فیزیولوژیک ایزوآنزیم استخوانی ALP در کودکان در حال رشد سالم رخ می دهد، اما افزایش پاتولوژیک مربوط به افزایش فعالیت استئوبلاستیک (استخوان سازی) است. این افزایش فعالیت استئوبلاستیک در حالتهایی مانند تخریب استخوان (که با ترمیم همراه است)، ریکتز (نرمی استخوان در کودکان)، استئومالاسی (نرمی استخوان در بزرگسالان)، پرکاری پاراتیروئید با دیستروفی (تحلیل پیشرونده) استخوانی، بیماری پاژه، تومورهای استخوانی (سارکوم استئوژنیک، سارکوم ِ Ewing)، و تومورهای متاستاتیک استخوانی درمان شده با کلسی تونین دیده می شود.
یک ایزوآنزیم ALP استخوانی دیگر وجود دارد که در منطقه مربوط به alpha 1 – alpha 2 قرار می گیرد، اگرچه به ندرت در کودکان دیده شده است. این ایزوآنزیم بر خلاف ایزوآنزیم استخوانی معمولی، به حرارت مقاوم بوده و با افزایش سن ناپدید می شود بدون اینکه بر روی رشد کودک اثری داشته باشد.
ایزوآنزیم Fast Liver
نام دیگر آن، ایزوآنزیم صفراوی یا ماکروهپاتیک (macrohepatic) است که در ناحیه alpha 1 قرار می گیرد و هیچگاه در افراد سالم دیده نمی شود. این ایزوآنزیم یک مارکر بسیار حساس و سریع کلستاز های داخل و خارج کبدی است، حتی زمانی که ALP تام در حد طبیعی باقی مانده و افزایش پیدا نکرده است. بررسی این ایزوآنزیم در پیگیری و پایش (Follow up) روند پیشرفت بیماران سرطانی بسیار مفید است. پدیدار شدن آن در سرم، احتمال وجود متاستاز کبدی را مطرح می کند. حساسیت و اختصاصیت این ایزوآنزیم در مقایسه با سایر آنزیم هایی که برای تشخیص اختلالات کبدی مورد استفاده قرار می گیرند ALP) تام، γ-GT، (5’nucleotidase بیشتر است، بطوری که در 96% بیماران مبتلا به سرطان کبد متاستاتیک یافت می شود. این ایزوآنزیم همچنین در حدود یک سوم بیماران مبتلا به سیروز کبدی و همچنین بطور اتفاقی در بیماران مبتلا به بیماری های کبدی غیر سرطانی مانند هپاتیت دیده می شود.
ایزوآنزیم روده ای
این ایزوآنزیم که در منطقه beta 2 قرار می گیرد، در افراد سالم و طبیعی با گروه خونی B یا O و بخصوص بعد از غذا خوردن دیده می شود. علاوه بر این، افزایش ایزوآنزیم روده ای در حالات پاتولوژیکی مانند سیروز، دیابت شیرین، بیماری کرون، بیماری التهابی روده (IBD) ، کولیت اولسراتیو و سرطانهای مجاری گوارشی دیده می شود. ایزوآنزیم روده ای اگر همراه با ایزوآنزیم Fast Liver دیده شود، می تواند نشانگر کلستاز داخل کبدی باشد.
ایزوآنزیم جفتی (placental)
این ایزوآنزیم بطور طبیعی دیده نمی شود، بجز در خانم های باردار (از هفته شانزدهم پدیدار شده و تا هنگام زایمان افزایش می یابد و حدودا 3 تا 6 روز پس از زایمان ناپدید می شود).
همچنین افزایش چشمگیر آن در فشار خون بالا و پره اکلامپسی دیده می شود. ایزوآنزیم جفتی به حرارت 65 درجه سانتیگراد مقاوم است، بنابراین، این ویژگی به راحتی امکان افتراق آن را از سایر ایزوآنزیم های ALP فراهم می می کند.
ایزوآنزیم های انکوژنیک (مرتبط با تومور)
چندین ایزوآنزیم ALP مرتبط با تومور شناسایی شده است که عبارتند از: Nagao, Regan, Timberly.
حرکت الکتروفورتیکی، آنتی ژنیسیته، و مقاومت به حرارت این ایزوآنزیم ها به ایزوآنزیم جفتی شباهت دارد. ایزوآنزیم های توموری ALP ، در چندین بدخیمی از جمله سرطان تخمدان و سرطان های ریه دیده می شوند. باند مربوط به این ایزوآنزیم ها پس از درمان موقیت آمیز سرطان ناپدید می شود.
تهیه شده توسط:
واحد تحقیق و توسعه (R & D) آزمایشگاه پاتوبیولوژی وحید
دکتر احسان کاکاوندی، دکتر محمد وحید دستجردی
تهیه شده توسط واحد تحقیق و توسعه (R & D) آزمایشگاه پاتوبیولوژی وحید: دکتر احسان کاکاوندی، دکتر محمد وحید دستجردی
:References
- Jacobs & DeMott Laboratory Test Handbook with Key Word Index 5th Edition
- Fishman WH, Perspectives on Alkaline Phosphatase Isoenzymes, The American Journal of Medicine, 1974; 56: 617-650